DERS: 3
ÜNİTE 3: MADDENİN YAPISI VE ÖZELLİKLERİ
KONU: ELEMENTLER-BİLEŞİKLER
MADDENİN TANECİKLİ YAPISI VE ATOM Saf maddeler aynı cins atom yada moleküllerden meydana gelir.
MADDENİN TANECİKLİ YAPISI VE ATOM Saf maddeler aynı cins atom yada moleküllerden meydana gelir.
Aynı cins atomlardan oluşanlara element, iki ya da daha fazla farklı cins atomdan oluşanlara ise bileşik denir. Bileşikler aynı cins moleküllerden oluşmuştur.
Element ve bileşikler saf maddelerdir.
Elementler: Aynı cins atomlardan meydana gelen saf maddeye element denir.
Demir, bakır, oksijen,klor,helyum,kurşun,gümüş,altın element örnekleridir.
Elementler fiziksel veya kimyasal yollarla daha basit maddelere ayrılmaz.
Elementlerin Sembollerle Gösterilmesi
Kimyasal hesaplamalarda maddelerin Lâtince isimleriyle işlem yapmak zordur.
Bu nedenle Elementler uluslararası geçerliliği olan Lâtince isimlerinin kısaltmasından oluşan semboller ile gösterilir.
Element sembollerinin ilk harfi her zaman büyük, varsa diğerleri daima küçük yazılır.
Bu nedenle Elementler uluslararası geçerliliği olan Lâtince isimlerinin kısaltmasından oluşan semboller ile gösterilir.
Element sembollerinin ilk harfi her zaman büyük, varsa diğerleri daima küçük yazılır.
Hidrojen H Helyum He
Karbon C Berilyum Be
Demir Fe Sodyum Na
Karbon C Berilyum Be
Demir Fe Sodyum Na
Kalsiyum Ca Bor B
Molekül: Maddenin tüm özelliğini taşıyan en küçük birimine molekül denir.Moleküller maddenin tüm özelliklerini gösterir ve bağımsız olarak hareket edebilir.
Örnek: H2O, CO2,H2, O2 molekülü.
Aynı cins atomlardan oluşan moleküllere element molekülleri denir.
Cl2,O2, H2, F2, N2 , I2 element molekülleridir. Bunlar bileşik değildir.
Su, karbondioksit,amonyak,glikoz,sofra tuzu bileşik örnekleridir.
Bileşikler formüllerle gösterilir.
Elementlerin belirli oranlarda birleşmesiyle meydana gelir.
Kendisini oluşturan elementlerin özelliklerinden tamamen farklı özellik taşır.
Kendilerini oluşturan elementlere kimyasal yollarla ayrıştırılabilir.
Farklı cins atomların molekülleri bileşik moleküllerini oluşturur.
H2O, CO2, C6H12O6 , NH3 bileşik molekülleri
Bileşik Formüllerinin Yazılması: Bileşikler kimyasal formüllerle gösterilir. Formüller, bileşik molekülündeki atomların cinsini ve sayısını gösterir.
Kimyasal tepkimelerin formülle gösterilmesine kimyasal denklem denir.
Kimyasal Tepkimelerde:
Kütle korunur.
Atom cinsi ve sayısı korunur.
Kimyasal denklemler denkleştirilirken elementlerin atom sayıları denkleştirilir.En son hidrojen ve oksijen elementleri eşitlenir.
Tepkimeye Tepkimeden
Girenler Çıkanlar
H2 + O2 ------------> H2O
2H2 + O2 ---------> 2H2O ( Denkleştirilmiş Hali ),
H2 + N2 ----------> NH3
3H2 + N2 --------------->2NH3 ( Denkleştirilmiş Hali )
Mg + HCl ------------> MgCl2 + H2
Mg+2 HCl -----------> MgCl2 +H2 (Denkleştirilmiş Hali)
Tepkimelerde Kütlenin Korunumu
Kimyasal değişimler oluşurken, tepkimeye giren maddeler yok olmazlar sadece yeni maddelere dönüşürler.Bir kimyasal reaksiyona giren maddeler ile reaksiyon sonucu oluşan maddelerin kütleleri birbirine eşittir. Buna" Kütlenin Korunumu Kanunu "denir.
H2 + ½ O2 -----------------> H2O
2g + 16g = 18g
Bileşik Formüllerinin Yazılması: Bileşikler kimyasal formüllerle gösterilir. Formüller, bileşik molekülündeki atomların cinsini ve sayısını gösterir.
Bir bileşik molekülündeki atomların cinsi ve sayısının gösterilmesine molekül formülü adı verilir.
Atomların birbirine nasıl bağlandığını gösteren formüle de yapı formülü denir.
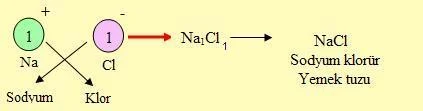
Bileşik Formülü (Çaprazlama Yöntemi)
Bileşiklerin formülü yazılmadan önce, bileşiği oluşturan elementlerin iyon yükü bulunur ve elementlerin sağ üst köşelerine yazılır. Ardından çaprazlama yapılarak, iyon yükleri sembollerin sağ altına yazılır.
Burada dikkat edileceği gibi önce (+) yüklü, sonra (–) yüklü iyon yazılarak çaprazlama yapılır. Ve yüklerin sadece rakamları yazılır. İşaretleri yazılmaz.Eğer sayılar eşitse sembollerin altına sayı yazılmaz.Böylece bileşik formülü elde edilir.
Mg+2 O–2 MgO
Mg+2 Cl–1 MgCl2
X+3 Z–2 X2Z3
şeklinde gösterilir.
Bileşik Yazma Tablosu:Aşağıdaki tablodan yararlanarak bileşik yazmayı daha kolay öğrenebilirsiniz.
Bileşiklerin Atomlarını Sayalım: Aşağıdaki tabloda bileşikleri ve atom sayılarının bulunuşunu inceleyiniz.

KİMYASAL TEPKİMELER
Atomların birbirine nasıl bağlandığını gösteren formüle de yapı formülü denir.
Bileşik Formülü (Çaprazlama Yöntemi)
Bileşiklerin formülü yazılmadan önce, bileşiği oluşturan elementlerin iyon yükü bulunur ve elementlerin sağ üst köşelerine yazılır. Ardından çaprazlama yapılarak, iyon yükleri sembollerin sağ altına yazılır.
İşlem Sırası
(+ yüklü iyon ) ( - yüklü iyon ) ( çaprazlama )= FormülBurada dikkat edileceği gibi önce (+) yüklü, sonra (–) yüklü iyon yazılarak çaprazlama yapılır. Ve yüklerin sadece rakamları yazılır. İşaretleri yazılmaz.Eğer sayılar eşitse sembollerin altına sayı yazılmaz.Böylece bileşik formülü elde edilir.
Mg+2 O–2 MgO
Mg+2 Cl–1 MgCl2
X+3 Z–2 X2Z3
şeklinde gösterilir.
Bileşik Yazma Tablosu:Aşağıdaki tablodan yararlanarak bileşik yazmayı daha kolay öğrenebilirsiniz.
Bileşiklerin Atomlarını Sayalım: Aşağıdaki tabloda bileşikleri ve atom sayılarının bulunuşunu inceleyiniz.

KİMYASAL TEPKİMELER
Bir maddenin başka maddeler ile etkileşerek veya kendiliğinden bozunarak farklı maddelere dönüşmesine kimyasal tepkime denir.
Basit Tepkime Denklemlerinin Yazılması ve DenkleştirilmesiKimyasal tepkimelerin formülle gösterilmesine kimyasal denklem denir.
Kimyasal Tepkimelerde:
Kütle korunur.
Atom cinsi ve sayısı korunur.
Kimyasal denklemler denkleştirilirken elementlerin atom sayıları denkleştirilir.En son hidrojen ve oksijen elementleri eşitlenir.
Tepkimeye Tepkimeden
Girenler Çıkanlar
H2 + O2 ------------> H2O
2H2 + O2 ---------> 2H2O ( Denkleştirilmiş Hali ),
H2 + N2 ----------> NH3
3H2 + N2 --------------->2NH3 ( Denkleştirilmiş Hali )
Mg + HCl ------------> MgCl2 + H2
Mg+2 HCl -----------> MgCl2 +H2 (Denkleştirilmiş Hali)
Tepkimelerde Kütlenin Korunumu
Kimyasal değişimler oluşurken, tepkimeye giren maddeler yok olmazlar sadece yeni maddelere dönüşürler.Bir kimyasal reaksiyona giren maddeler ile reaksiyon sonucu oluşan maddelerin kütleleri birbirine eşittir. Buna" Kütlenin Korunumu Kanunu "denir.
H2 + ½ O2 -----------------> H2O
2g + 16g = 18g

0 yorum:
Yorum Gönder